El Gobierno firmó dos acuerdos para la producción nacional de fármacos con Laboratorios Dr. Reddy´s, de origen indio, el cual es investigado por la Food and Drug Administration (FDA) por malas prácticas que causaron la adulteración de sus medicamentos
Paralelamente, los ministerios de Comercio y Finanzas de India le propusieron al gobierno venezolano un intercambio de “petróleo por medicinas” que posibilite la repatriación de ganancias a los laboratorios, que en el caso de Dr. Reddy´s, sumaron $136 millones en 2015
EL SEGUNDO MOTOR PRODUCTIVO -el farmacéutico-, el Gobierno quiere ponerlo a funcionar como sea. Para encenderlo ha firmado dos alianzas estratégicas para la producción de medicamentos genéricos en el país con Laboratorios Dr. Reddy´s, una empresa de fármacos india que tiene más de 15 años operando en Venezuela, que desde noviembre de 2015 ha sido señalada por la FDA por un cúmulo de malas prácticas en el proceso de control de calidad. que produjo la adulteración de los ingredientes farmacéuticos activos de tres de sus plantas.
Pero ese detalle fue omitido por el vicepresidente ejecutivo, Aristóbulo Istúriz, cuando el 18 de febrero de este año, durante el acto realizado en el palacio de Miraflores, presentó formalmente al laboratorio que sería responsable de reactivar la producción nacional de medicamentos: “Dr. Reddy´s es una empresa de la India, muy prestigiosa mundialmente”, dijo Istúriz en el evento al que asistieron las cámaras farmacéuticas del país.
En la firma del segundo convenio estratégico no solo estuvo presente el gerente general de Laboratorios Dr. Reddy´s Venezuela, Jayadeep Shukla, sino también el embajador de la India, Rahul Shrivastava. “Ayúdennos en esta situación de emergencia”, les pidió a ambos el presidente Nicolás Maduro.
La FDA -Agencia de Alimentos y Medicamentos estadounidense encargada de regular y certificar todo lo relacionado con el ámbito sanitario-, tiene bajo su jurisdicción la inspección de fabricantes y procesadores de productos regulados, a fin de verificar que cumplan con el reglamento pertinente. Este organismo inspecciona rutinariamente las plantas de laboratorios extranjeros que exportan a los Estados Unidos. Fue justamente durante un ciclo de tres inspecciones a las plantas de Dr. Reddy´s en India, llevadas a cabo entre 2014 y 2015, que la FDA identificó violaciones que llevaron al organismo a «cuestionar la efectividad del actual control de calidad de la empresa», tras lo cual emitió la carta pública de alerta.
Dr. Reddy’s. el segundo laboratorio de genérico más grande de India, está al tanto de las conclusiones de la investigación que condujo el organismo norteamericano desde el 5 de noviembre de 2015. En la notificación, la FDA enumera y describe “violaciones significativas y recurrentes al Manual de Buenas Prácticas Farmacéuticas”, detectadas durante el proceso de manufactura de los API y también en el proceso de control de calidad de los productos terminados.
“Los métodos usados en los laboratorios y los mecanismos de control de calidad utilizados para la manufactura, procesamiento, empaquetado y almacenamiento, no están en conformidad con el Manual de Buenas Prácticas Farmacéuticas”, explica la FDA.
El laboratorio ha publicado en la sección “medios” de su página Web, varios comunicados en respuesta a la investigación de la FDA. La nota de prensa del 6 de noviembre de 2015 declara: “Nosotros tomamos seriamente las normas de control de calidad y manifestamos nuestro compromiso y total apego a las normas del Manual de Buenas Prácticas Farmacéuticas en todas nuestras plantas. Vamos a responder de manera cabal a las observaciones dentro del plazo estipulado de 15 días. Seguiremos colaborando activamente con la agencia (FDA) para resolver estos temas”.
Luego de la divulgación de la carta de alerta, las repercusiones económicas para Dr. Reddy´s no se hicieron esperar. La cotización de sus acciones llegó a su punto más bajo a finales de enero de este año, principalmente debido a las sanciones que podría enfrentar el laboratorio, tales como la reducción del número de los ingredientes farmacéuticos activos que procesa y de los productos terminados que manufactura; así como la prohibición de exportación hacia los Estados Unidos.
La versión actualizada en 2004 del Manual de Buenas Prácticas Farmacéuticas de la FDA, hace hincapié en la necesidad de mantener los estándares de manufactura de la industria, y advierte sobre algunas posibles consecuencias para los consumidores. “Un apego deficiente a las buenas prácticas de manufactura en los laboratorios, trae consigo riesgos que amenazan la vida de los pacientes”.
¿Es posible burlar el control sanitario nacional?
Dr. Reddy´s tiene presencia en Venezuela desde hace 15 años y los 20 productos que actualmente comercializa cuentan con el debido registro sanitario; no obstante, fuentes del sector farmacéutico que solicitan el resguardo de su identidad, explican que hay dos consideraciones importantes con relación a la obtención del registro sanitario en Venezuela.
La primera, que si bien el Instituto Nacional de Higiene sostiene que ellos realizan todos los análisis de bioequivalencias antes de otorgar el registro, fuentes aseguran que la falta de recursos los limitaría a realizar solamente una revisión de la documentación que presentan los laboratorios. Cuando se les consultó directamente sobre este tema, representantes del Instituto negaron rotundamente esta posibilidad.
La segunda consideración en torno a la rigurosidad del control sanitario nacional tiene que ver con las compras directas que realiza el Estado a proveedores internacionales bajo la figura de productos de servicio, que es una categoría que únicamente está prevista para la compra de productos para enfermedades de baja incidencia, según se explica en la página Web del Instituto de Higiene.
“Con esa figura legal, y bajo el supuesto de resolver situaciones de emergencia, el Estado ha llegado a asumir directamente hasta 80% de las compras de medicamentos a proveedores extranjeros -principalmente de Cuba e India-; estos medicamentos se distribuyen a través del Sistema Público Nacional de Salud y muchas veces obtienen los permisos por medio de presiones políticas y administrativas. Para un producto importado por el Estado exigen muy pocos o ningún requisito”, describe una fuente del sector farmacéutico.
¿A qué riesgos se exponen quienes consumen medicamentos que no cumplen con estándares internacionales? De acuerdo con la Organización Mundial de la Salud, el uso de medicamentos cuya producción no se rige por los estándares del Manual de Buenas Prácticas Farmacéuticas: “No solo implica un peligro para la salud, sino también una pérdida de dinero para los gobiernos y consumidores (…). Un medicamento de mala calidad puede contener sustancias tóxicas que se han añadido de manera inadvertida; y puede contener poco o nada del ingrediente farmacéutico activo para lograr el efecto terapéutico deseado”.
Venezuela: un mercado estratégico al que hay que “acercarse con cautela”
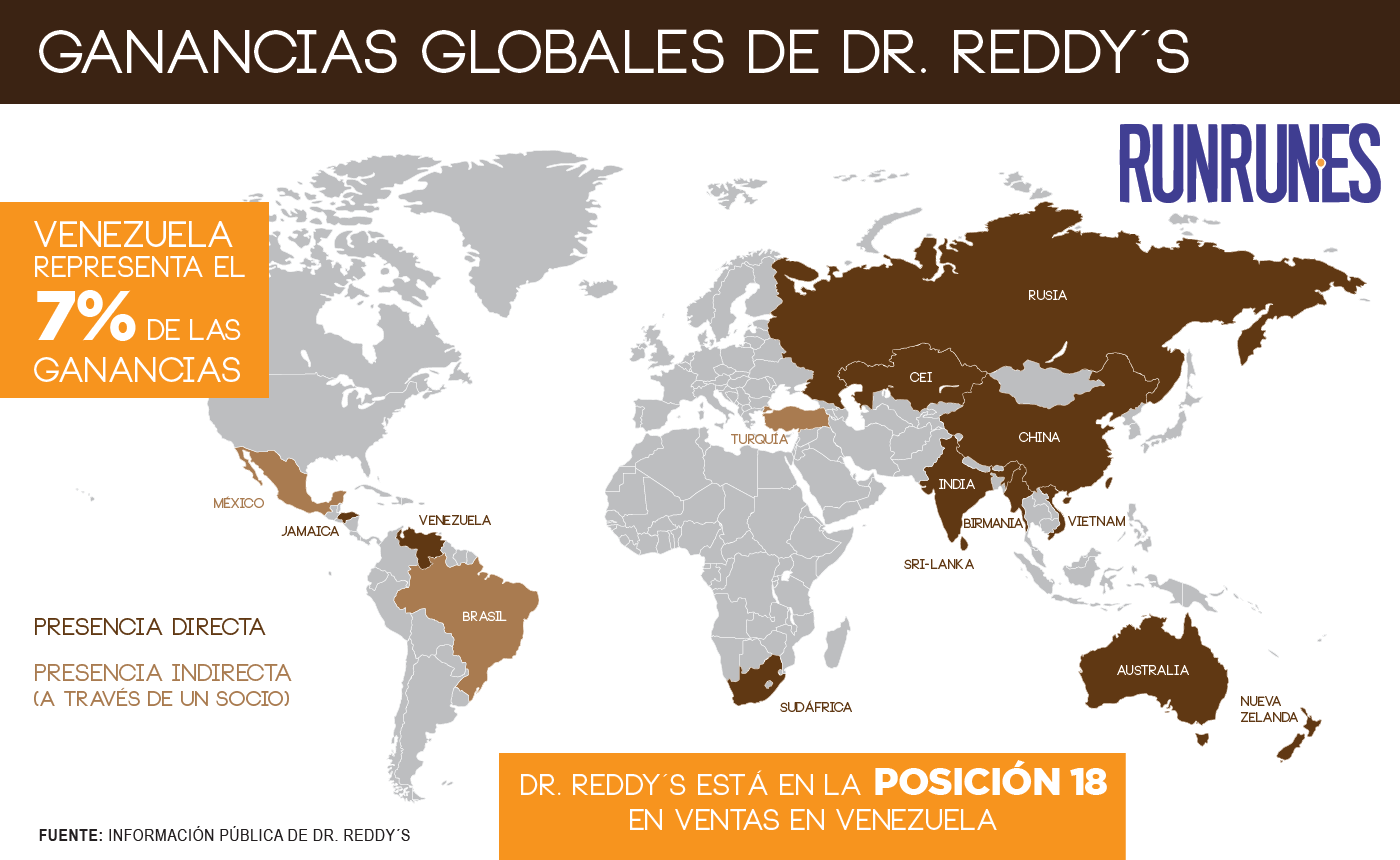
Los números demuestran que la relación comercial con Venezuela ha sido estratégica para el crecimiento del laboratorio: 7% de las ganancias totales del portafolio global de genéricos de la empresa provienen de Venezuela, según consta en su declaración fiscal al cierre de 2015; además, el país está catalogado como uno de sus principales mercados emergentes.
El documento reseña que Dr. Reddy´s ocupa la posición 18 en ventas en el país, y que los cuatro productos con mayor demanda son: Zovanta, Omez, Ciprolet y Plagril; los cuales representaron 64% de las ventas. Zovanta y Omez -pantoprazol y omeprazol-, se recetan para úlceras gástricas; Ciprolet -ciprofloxacina-, se emplea para tratar infecciones bacterianas; y Plagril se receta para tratar el síndrome coronario agudo.
De acuerdo con información oficial de la empresa, al cierre del año fiscal 2015 Dr. Reddy´s Venezuela reportó ganancias por $136 millones; 53% más que en 2014, cuando registró beneficios por $48 millones; que se suman a los $35 millones de 2013; a los $26 millones de 2012; y a otros $26 millones de 2011.
La declaración fiscal confirma que la empresa, hasta marzo de 2015, había recibido la aprobación de divisas por parte del Cencoex a la tasa preferencial de 6,30 Bs por dólar. Sin embargo, el documento revela que, “muy probablemente”, el Estado venezolano le pagará los compromisos pendientes con base en la extinta tasa Simadi, lo que representaría una pérdida financiera para Dr. Reddy´s por el orden de los $12 millones.
Pese a lo adverso del contexto económico nacional, la proyección del laboratorio es que, aunque haya que “acercarse con cautela” debido a la “agitación económica”, esta crisis es “una oportunidad para mantener presencia en el mercado y fortalecer las bases para el futuro”, según reza en el documento que el laboratorio presentó en febrero de este año a potenciales inversionistas.
Las bases de ese próspero futuro descansan sobre dos pilares: los convenios con el Gobierno para arrancar el motor farmacéutico; y la puesta en práctica de una propuesta de acuerdo bilateral entre India y Venezuela para el intercambio de “petróleo por medicinas”.
Los dos convenios con el Estado se firmaron en diciembre de 2015 y febrero de 2016. El primero se describe como una “alianza estratégica para la producción nacional de fármacos de primera necesidad e inversiones en maquinaria y equipos para el aumento de capacidad y diversificación de producción de las líneas instaladas del Servicio Autónomo de Elaboraciones Farmacéuticas (Sefar)”, reflejado en la Memoria y Cuenta 2015 del Ministerio del Poder Popular para la Salud (MPPS).
Del segundo, firmado durante la cadena nacional del 18 de febrero de este año, no han trascendido mayores detalles, salvo que se realizará de manera conjunta con la Empresa Socialista para la Producción de Medicamentos Biológicos (Espromed Bio, C.A.), creada en junio de 2014 y adscrita al MPPS.
En teoría, el segundo acuerdo implica la producción de medicamentos en el país, lo cual será un reto para ambas empresas ya que hasta la fecha, Dr. Reddy´s ha importado todos los productos que comercializa en Venezuela; y según la Memoria y Cuenta 2015 del MPPS, Espromed Bio, C.A. se dedicó en 2015 al “envasado y etiquetado” de 21.718.906 dosis de productos biológicos y medicamentos esenciales, los cuales fueron adquiridos en Cuba a través del Convenio Integral de Cooperación entre ambos países.
De acuerdo con el documento del MPPS, Espromed Bio, C.A. tiene previsto realizar en 2016 el proyecto: “Impulso de la producción, comercialización y desarrollo de medicamentos y productos biológicos para el fortalecimiento y consolidación de la Soberanía Farmacéutica Nacional y el bienestar del pueblo venezolano”, para el cual cuenta con una asignación presupuestaria de Bs. 532.467.642,00.
De importadores a productores nacionales
“Ellos hasta ahorita están apoyándonos surtiendo medicamentos, pero el compromiso central es producir”, dijo el vicepresidente en el acto de arranque del motor farmacéutico, en alusión al segundo convenio firmado con Dr. Reddy´s.
Las voces que piden dar prioridad a la producción nacional frente a las importaciones se dejaron escuchar durante el acto del 18 de febrero: “Es un pecado importar un medicamento que se puede fabricar en el país”, aseveró Jorge Rivas, presidente de la Cámara Nacional de Medicamentos Genéricos y Afines.
“Reafirmamos nuestra satisfacción con la puesta en marcha de este motor; la industria instalada en el país puede llegar a abastecer hasta 70% de la demanda; las tres Cámaras tienen suficientes plantas como para satisfacer hasta 400 millones de unidades. En promedio, por estuche importado pagamos 5 o 6 dólares, pero producirlas cuesta 2 o 3 dólares; ahí se le va al Estado el presupuesto de divisas que no tenemos. Hay que producir en el país porque es más barato que importar, salvo por los medicamentos que no se puedan producir, esos sí habrá que importarlos”, argumentó Rivas, quien además se desempeña como vicepresidente del Grupo de Empresas Leti (Genven, Leti y Biocontrol).
En dicho acto, la ministra del Poder Popular para la Salud, Luisana Melo, hizo justamente esa pregunta durante su intervención: “¿Cuáles son los medicamentos que se necesitan realmente? Hay un grupo de medicamentos que no estamos en capacidad de producir y que debemos importar”, dijo.
Fuentes del sector farmacéutico confirman que 18 de los 20 medicamentos que ha venido importando Laboratorios Dr. Reddy´s, y para los cuales el Cencoex aprobó las correspondientes divisas, se pudieron haber manufacturado en Venezuela con la capacidad instalada existente, lo que hubiese generando empleos al sector y abaratado los costos para el Estado.
En efecto, el propio Rivas explicó en una entrevista concedida a El Mundo Economía y Negocios, que “mientras las multinacionales requieren entre 2.500 y 3.000 millones de dólares cada año para importar, las empresas nacionales no demandan más de $1.000 (…)”; acotó que en el país se produce 60% de los medicamentos que se consumen, un total de 730 millones de unidades; mientras que el restante 40% es importado.
A falta de dólares: ¿petróleo por exportaciones farmacéuticas?
Con la merma de los ingresos petroleros luce poco probable que, en el corto plazo, el Estado logre honrar sus compromisos con los proveedores de materia prima del sector farmacéutico. La deuda que sobrepasa los $6 mil 500 millones, según la Cámara de la Industria Farmacéutica (Cifar), es el principal obstáculo para que los laboratorios nacionales e internacionales que producen en el país reactiven plenamente su capacidad operativa.
A juzgar por una frase de Maduro dicha en el acto del 18 de febrero, es evidente que Laboratorios Dr. Reddy´s no escapa de la presión por llegar a un compromiso con el Gobierno que le garantice el retorno de su inversión: “Resolvamos los temas financieros, que siempre hay que resolverlos”, le dijo el presidente al representante de la empresa india.
Esa voluntad para “resolver” el tema financiero podría darse través de un acuerdo bilateral entre India y Venezuela, según se propone en un documento con fecha de 7 de septiembre de 2015, emanado de la Cámara India para la Promoción de la Exportación Farmacéutica (Pharmexcil), ente adscrito al Ministerio de Comercio de ese país.
El documento evidencia que varias empresas agrupadas bajo dicho gremio, entre ellas, Dr. Reddy´s, Glenmark, Sun Pharmaceutical y Claris Life Sciences, las cuales han tenido dificultad para repatriar capitales debido al control cambiario, le han solicitado al Ministerio de Comercio e Industria que gestione ante el Gobierno venezolano, la implementación de un acuerdo bilateral que permita realizar los pagos por concepto de exportaciones de medicamentos, a través de las respectivas empresas petroleras.
Cabe destacar que en 2012, Petróleos de Venezuela y la empresa india Reliance Industries, firmaron varios acuerdos para desarrollar actividades de exploración y producción de crudo en los bloques Boyacá 4 y Ayacucho de la Faja Petrolífera del Orinoco; también para la producción de gas mediante el proyecto Mariscal Sucre. Adicionalmente, se conformó una empresa mixta para el área de refinación, a fin de desarrollar proyectos como el de Cabruta (Guárico) y Santa Inés (Barinas).
La implementación de este mecanismo ofrecería ventajas no solo a las empresas farmacéuticas indias que exportan hacia Venezuela, las cuales tendrían una vía para repatriar sus capitales, sino también representaría un alivio para un Gobierno que carece de liquidez en divisas para paliar la situación de emergencia en el sector salud, tal y como lo reconoció el propio Maduro aquel 18 de febrero. Queda por dilucidar qué ganan los venezolanos cuando su Gobierno firma un convenio con un laboratorio que está bajo la lupa de la FDA.
Runrun.es solicitó personalmente y por escrito, tanto a Dr. Reddy´s Venezuela como a Pharmexcil, confirmación de la entrada de vigor del mecanismo “petróleo por exportaciones farmacéuticas”; también solicitó información sobre la investigación que conduce la FDA. Al momento del cierre de este reportaje no se había recibido respuesta de ninguna de las partes.